Урок химии в 9 классе по теме: «Азот» Цель урока: сформировать понятие об азоте как о химическом элементе и простом веществе
 Скачать 36.71 Kb. Скачать 36.71 Kb.
|
| Булганина Марина Владимировна Старооскольский район Белгородской области Урок химии в 9 классе по теме: «Азот» Цель урока: сформировать понятие об азоте как о химическом элементе и простом веществе. Задачи урока: обучающие –
развивающие –
воспитательные –
Оборудование: таблица «Периодическая система Д.И.Менделеева», презентация урока, цифровые образовательные ресурсы, медиапроектор, компьютер, дидактические карточки, пособие «Решение задач по химии с помощью формул». Ход урока: I Организационный момент – формулировка темы и цели урока. II Актуализация ранее полученных знаний Характеристика азота на основании его положения в Периодической системе Д.И.Менделеева. III Изучение нового материала. Рассказ учителя с элементами беседы по плану:
Заполнение таблицы (задание 1).
Заполнение схемы (задание 2). 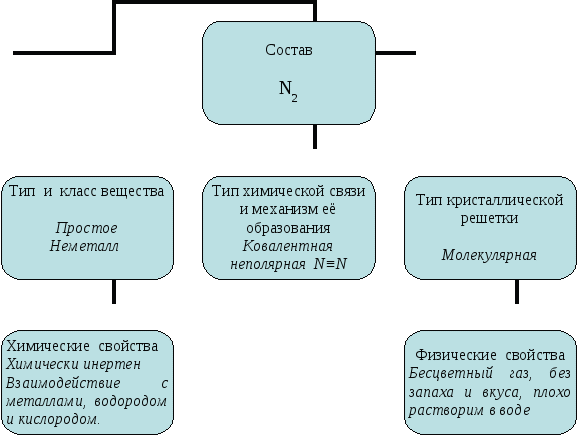 Выполнение задания 3. Перечислить условия смещения химического равновесия вправо (→) в следующих реакциях: а) N2 + 3Н2 ↔ 2 NН3 + Q _________________________________ б) N2 + О2 ↔ 2 NО - Q _________________________________
IV Обобщение и закрепление.
Задача 1. Сколько грамм кальция потребуется для взаимодействия с 28 граммами азота? Задача 2. Сколько литров воздуха, содержащего 78 % азота, потребуется для получения 100 литров аммиака? Задача 3. Сколько грамм нитрида алюминия можно получить из 54 грамм алюминия и 66,2 литров азота? V Подведение итогов урока Домашнее задание. § 23, упр. 2,3,4а,5. АЗОТ Задание 1. Заполните таблицу «Характеристика азота на основании его положения в Периодической системе Д.И.Менделеева».
Задание 2. Заполните схему  Задание 3. Перечислить условия смещения химического равновесия вправо (→) в следующих реакциях: а) N2 + 3Н2 ↔ 2 NН3 + Q _________________________________ б) N2 + О2 ↔ 2 NО - Q _________________________________ Решение задач Задача 1. Сколько грамм кальция потребуется для взаимодействия с 28 граммами азота? Задача 2. Сколько литров воздуха, содержащего 78 % азота, потребуется для получения 100 литров аммиака? Задача 3. Сколько грамм нитрида алюминия можно получить из 54 грамм алюминия и 66,2 литров азота? | ||||||||||||||||||||||||||||||||