Урок по теме «Металлы» Дата: Предмет: химия Класс: 9 Учитель: Малишевская Светлана Валентиновна обобщающий урок по теме «металлы»
 Скачать 282.17 Kb. Скачать 282.17 Kb.
|
| ПРОЕКТ ОТКРЫТОГО МЕРОПРИЯТИЯ НА ТЕМУ « Обобщающий урок по теме «Металлы» Дата: Предмет: химия Класс: 9 Учитель: Малишевская Светлана Валентиновна ОБОБЩАЮЩИЙ УРОК ПО ТЕМЕ «МЕТАЛЛЫ» Цели: Обучающая – обобщить знания учащихся об основных свойствах элементов-металлов и образуемых ими простых и сложных веществ. Воспитательная – воспитывать экологическую культуру (на примере последствий загрязнения окружающей среды тяжелыми металлами), ответственное отношение к собственному здоровью (в связи с необходимостью или вредом поступления в организм некоторых металлов). Развивающая – совершенствовать умения экспериментально подтверждать химические свойства веществ, на основе теоретических знаний, выполнять практические задания, выявлять существенное, делать выводы, устанавливать межпредметные связи, развивать экспериментальные умения, формировать мировоззренческие понятия о познаваемости природы. Оборудование: Компьютер, коллекция металлов, раствор CuSO4, HCl, Al, Na, Zn, железный гвоздь, вода. Тип урока: Урок обобщения и систематизации знаний. Методы обученя: -словесные (беседа, рассказ); - практические; -наглядные (таблицы, картинки). Ход урока: Орг. начало и постановка целей урока. Учитель. Девиз алхимиков XVIII в. совпадает с девизом нашего урока: Семь металлов создал свет По числу семи планет. Дал нам космос на добро Медь, железо, серебро, Злато, олово, свинец. Помни! Сера им отец. И спеши мой друг узнать- Всем им ртуть родная мать! 1 РАЗМИНКА Ответьте на предложенные вопросы. 1. Пули для ружей и пистолетов изготавливаются из этого металла (свинец) 2. Какой металл плавится от тепла человеческой руки? (цезий) 3. Самый распространённый металл в земной коре (алюминий) 4. От соединений какого металла зависит красный цвет крови? (железо) 5. Химический элемент, названный в честь нашей планеты (теллур) 6. Этот металл называют крылатым (алюминий) 7. Свойство атома химического элемента образовывать несколько простых веществ (аллотропия) 8. Металл "консервной банки" (олово) 9. Этилированный бензин содержит органическое соединение этого металла (свинец) 10. Металл, входящий в состав нержавеющих и жаропрочных сталей (хром) 11. Какой металл принесён в жертву "рыжему дьяволу"? (железо) 12. Без какого металла невозможна фотография? (серебро) 13. Какие металлы можно зажечь холодной водой? (щелочные) 14. Металл, входящий в состав рубина, граната, сапфира, бирюзы (алюминий) 15. Название металла происходит от латинского слова, которое в переводе означает "известь" (кальций) 16. Название металла в переводе с шумерского языка означает "капнувший с неба" (железо) 17. Ядро атома металла содержит 80 протонов (ртуть) 18. От соединений какого металла зависит зелёная окраска растений? (магний) 19. Атом какого металла содержит 12 электронов? (магний) 20. Самый тугоплавкий металл (вольфрам) Достаточно внимательно осмотритесь вокруг. Где бы вы ни были: дома или в школе, на улице или в транспорте – вы увидите, какое множество металлов трудится вокруг нас и для нас. На экран выводится слайд “Положение металлов в Периодической системе Д.И. Менделеева. 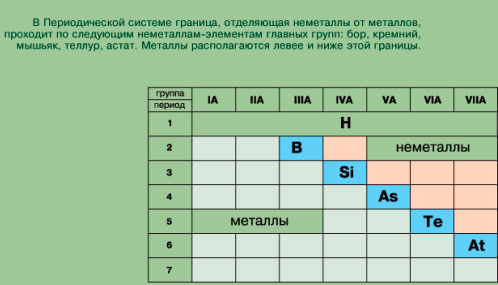 1. Положение металлов в Периодической системе Д.И. Менделеева. (фронтальный опрос)

-агрегатное состояние; -температура плавления (-390 ртуть, 34100 вольфрам) В зависимости от температуры плавления какие виды металлов выделяют; -плотность (?) Легкий-0,50-5 г/см3, тяжелые 5-22,5 г/см3) Литий и осмий (иридий-22,6 оба) Как зависит положение металла в ПСХЭ и плотность 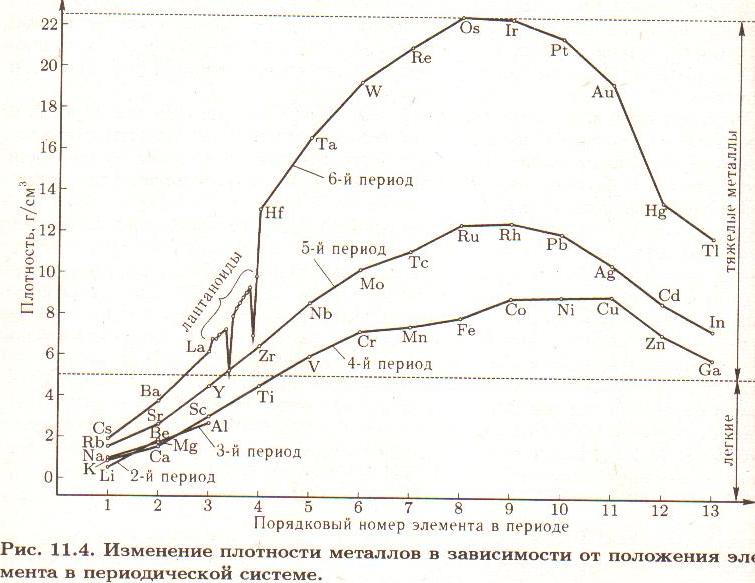 -пластичность (золото, медь, серебро) Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. -электропроводность- обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; - теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей; -металлический блеск - однако в порошкообразном состоянии большинство металлов теряют свой блеск; алюминий и магний, тем не менее, сохраняют свой блеск и в порошке. Наиболее хорошо отражают свет алюминий, серебро и палладий. 6. Почему металлы хорошо проводят тепло и ток? 7. Какой тип кристаллической решетки у металлов? 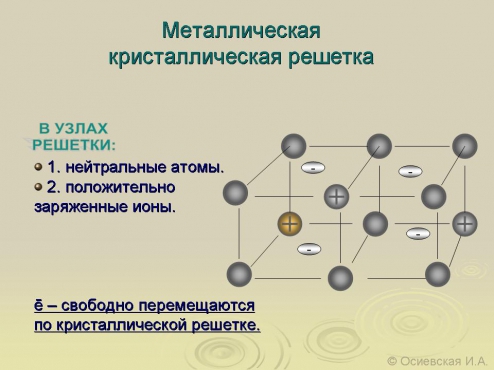 8. Алюминий – какие свойства проявляет этот элемент? Используя знания, полученные на уроках физики и химии и в процессе обсуждения зап олняем схему № 1 На экран выводятся две схемы – до обсуждения и после обсуждения. До обсуждения: 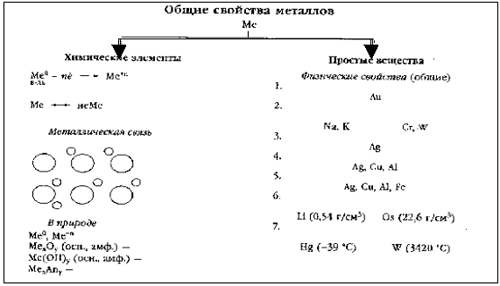 После обсуждения: 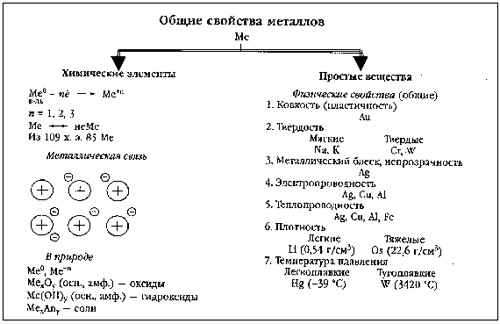 Химические свойства металлов На экран выводятся последовательно 4 слайда, в ходе обсуждения учениками демонстрируются химические реакции, подтверждающие свойства металлов. Ученикам, выполняющим демонстрационные опыты, напоминаю правила техники безопасности. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ ВО ВРЕМЯ РАБОТЫ 1. Во время работы в кабинете химии учащиеся должны быть максимально внимательными, дисциплинированными, строго следовать указаниям учителя, соблюдать тишину, поддерживать чистоту и порядок на рабочем месте. 2. При выполнении практических работ учащиеся должны неукоснительно соблюдать правила техники безопасности, следить, чтобы вещества не попадали на кожу лица и рук, так как многие из них вызывают раздражение кожи и слизистых оболочек. 3. Никакие вещества в лаборатории нельзя пробовать на вкус!Нюхать вещества можно, лишь осторожно направляя на себя их пары или газы лёгким движением руки, а не наклоняясь к сосуду и не вдыхая полной грудью. 4. запрещается выливать в канализацию растворы и органические жидкости. 5. Обо всех разлитых и рассыпанных реактивах учащиеся должны немедленно сообщить учителю или лаборанту. Учащимся запрещается самостоятельно убирать любые вещества. 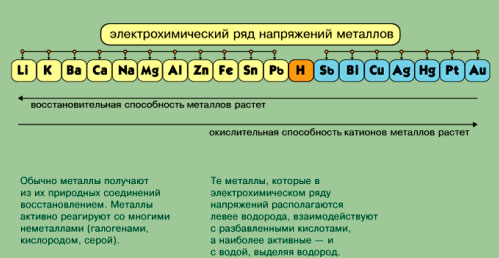 какие основные выводы об активности металлов можно сделать на основе изучения этого ряда?( Ожидаемые ответы: А). Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является. Б). Каждый металл способен вытеснять (восстанавливать из растворов солей те металлы, которые в ряду напряжений металлов стоят после него (правее) Учитель: Итак, как вы считаете, связаны ли с активностью металлов нахождение их в природе в виде простых веществ (в самородном состоянии) или в виде соединений? Подумайте и сделайте вывод (Металлы, завершающие электрохимический ряд напряжений (золото, платина) – только в самородном виде. Более активные, чем золото и платина, но также стоящие в электрохимическом ряду после водорода, обычно встречаются в природе в виде соединений или в самородном виде (серебро, медь – часто, ртуть, олово – редко). Металлы, стоящие в ряду напряжения до водорода встречаются в природе только в виде соединений с другими элементами.) 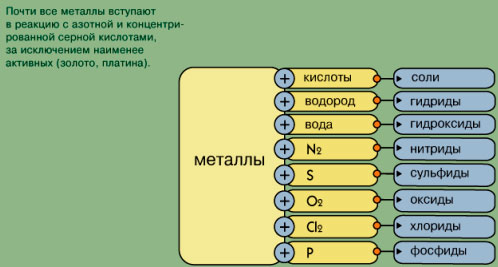  Допишите уравнения реакций.
Провести опыты 1) 2Mg + O2→2 MgO (бенгальский огонь); 2) 4Na + O2→2 Na2O (стакан с водой, натрий, тряпка, индикатор); 3) Zn+ 2 HCI → ZnCI2 + H2↑ (стакан, соляная кислота, цинк гранулы); 4) 3 CuSO4 + 2 Fe → 3 Cu + Fe2 (SO4)3 (пробирка, сульфат меди, железный гвоздь).  Формулируем общие характеристики элементов металлов I-III групп главных подгрупп. Семейство (тип элемента) – s или p. Число электронов на последнем энергетическом уровне (валентные электроны) – соответствует номеру группы. Степени окисления в соединениях – постоянные. Свойства простого вещества – металлические. Свойства соединений элементов с позиций теории окислительно-восстановительных реакций – восстановительные. Характер оксидов и гидроксидов – основной, у Al – амфотерный. VI. Обобщающее повторение. Металлы побочных подгрупп периодической системы. Повторение проводится в форме фронтальной беседы. 1)Составьте схему распределения электронов по орбиталям в атоме железа. Определите количество валентных электронов. 2)Охарактеризуйте свойства простого вещества железа (тип кристаллической решетки, характер связи, физические свойства). 3)Какая степень окисления железа в следующих соединениях: Fe(OH)2, FeCl3, K2FeO4, Fe2O3, Fe(OH)3. 4)Что является реактивом на катионы Fe2+ и Fe3+. 5)Какая степень окисления хрома в следующих соединениях: Cr(OH)3, CrO3, H2Cr2O7, Cr(OH)2, H2CrO4, CrO, Cr2O3. Характеристика элементов-металлов побочных подгрупп. Семейство (тип элемента) – d. Число электронов на последнем энергетическом уровне – 1-2. Число валентных электронов – как правило, соответствует номеру группы (кроме VIII). Степени окисления в соединениях – переменные. Свойства соединений элементов – окислительные и восстановительные. Характер оксидов и гидроксидов – основной, амфотерный и кислотный. Домашнее задание заполнить таблицу. Биологическая роль металлов.
1 вариант. Обобщающее повторение. Металлы главных подгрупп I-III групп. Работа в парах: Уровень А. Задание № 1. О физических свойствах какого металла идёт речь: серебристо-белого цвета, режется ножом, легкоплавкий? 1) Кальций; 2) Натрий. (Ответ: 2) Задание № 2. Какую степень окисления проявляет алюминий в соединениях? 1) +1, +3; 2) +3; 3) -3. (Ответ: 2) Задание № 3. Какой из металлов наиболее распространён в природе? 1) Ba; 2) Na; 3) Al. (Ответ: 3) Уровень Б. Задание № 1. Какие свойства проявляют щелочные металлы в химических реакциях? 1) Восстановительные; 2) Окислительные и восстановительные. (Ответ: 1) Задание № 2. К какому типу элементов относится кальций? 1) p-элемент; 2) s-элемент; 3) d-элемент. (Ответ: 2) Задание № 3. Какие из уравнений химических реакций доказывают свойства алюминия как промежуточного элемента между металлами и неметаллами: а) 2Al + 3Cl2 = 2AlCl3; б) 2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2^; в) 2Al + 6HCl = 2AlCl3 + 3H2^? 1) а, в; 2) б. (Ответ:2) Уровень С. Задание № 1. Какая схема строения последнего энергетического уровня соответствует атому алюминия? 1) 3s1; 2) 3s23p1; 3) 4s2. (Ответ: 2) Задание № 2. Какие из указанных реакций характеризуют восстановительные свойства кальция: а) Ca + S = CaS; б) Ca + H2 = CaH2; в) Ca + 2H2O = Ca(OH)2 + H2^; г) Ca + Cl2 = CaCl2? 1) а, б, в, г; 2) только а и г. (Ответ 1) Задание № 3. У какого элемента ярче выражены металлические свойства и почему? 1) Na; 2) K; 3) Rb; 4) Cs. (Ответ: 4, больший радиус атома) 2 вариант. Решение головоломок, ребусов, шарад. Задания раздает дежурный на парты. (работа парная). ШАРАДЫ 1) Двенадцать пар – не забывай! – У всех людей на свете. В другом значенье – узкий край, Так учат в школе дети. Но если СЕ ко мне прибавить, То вмиг в металл я превращусь. Еще к тому могу добавить, Что в первой группе окажусь. (Ребро – серебро.) 2) Два элемента химических В метаграмме я вам загадал: С X – элемент металлический, А с Б – я уже неметалл. (Хром – бром.) 3) Элемент IV группы Перед всеми на виду. Если Т на Р исправить, Будет деспот наяву. (Титан – тиран.) 4) Менделеев впервые меня предсказал. Французский ученый – название дал. Если в нем первую букву заменишь, Место в системе мне сразу изменишь. (Галлий – таллий.) 5) С КА – активный я металл, с ГЕ – я очень легкий газ. Чтобы нас ты разгадал, Глянь в систему еще раз. (Калий – гелий.) 6) Первый слог – предлог известный. Слог второй трудней найти: Часть его составит цифра, К ней добавьте букву Й. Чтобы целое узнать, Нужно вам металл назвать. (На, три, й – натрий.) Ребусы Шесть элементов  В этих буквенных ребусах зашифрованы названия шести химических элементов. Разгадать вам помогут следующие их свойства. 1) Элемент, для которого известны 10 стабильных природных изотопов с массовыми числами от 112 до 124. (Олово.) 2) Радиоактивный химический элемент, быстрораспадающийся изотоп которого имеет период полураспада 54 с. (Астат.) 3) Элемент, высший оксид которого применяют как катализатор в производстве серной кислоты. (Ванадий.) 4) Химический элемент V группы периодической системы. (Висмут.) 5) Щелочной металл. (Натрий.) 6) Металл, составляющий основу многих сплавов для авиационной и ракетной техники, судостроения. (Титан.) В сетку головоломки вписаны имена. Дополните эти имена так, чтобы получились названия химических элементов.
Ответы к заданию 3 «Головоломка»
ДОКЛАД УЧАЩЕГОСЯ 5 Литературный конкурс «КАРУСЕЛЬ» (учащимся предлагается вспомнить словосочетания, литературные выражения, пословицы, поговорки, строки из стихотворений, в которых упоминаются металлы) Металл — это такая вещь, которая, сколько ни прячешь, будет найдена. (японская) Владелец золотой горы тоже жаден.(японская) Золото добывают из земли, а знания – из книги. Молода жена плачет до росы утренней, сестрица – до золота кольца, мать – до веку. Не все то золото, что блестит Золото не в золото, не побыв под молотом. (персидская) Золотые руки на серебро не купишь. Не хвались серебром, а хвались добром. Кто живет в добре, тот ходит в серебре.(русская) Ребёнку нужна мать, полю - платина. (китайская) Сказанное слово – золото, несказанное – алмаз. Железом хлеб добывают. Железом хлеб добывают. ЗАГАДКИ От дождя я не ржавею, Не ломаюсь, не темнею. Как алмаз в бою крепка, Как лозиночка, гибка. Если крепко закалюсь - Никогда не отступлюсь. Буду дерево пилить, Резать ткань, металл сверлить, Научусь всему свободно! Все могу, на все пригодна - На педаль и на пищаль, На скрижаль и на медаль. Такова моя мораль! Дальше - мой автограф: сталь... Он идет на сковородки Да узорные решетки, Он совсем-совсем неловок, Невоспитан и нековок… Он ломается, как лед И тяжел, как бегемот. Но не врун и не болтун Работяга наш -...чугун Прославлен всеми письменами Металл, испытанный огнем, Манил к себе людей веками, Алхимик жил мечтой о нем. Но, как кумир, он свержен был, Уж блеск его не манит. Ведь хорошо мы знаем с вами: Не все то ценно, что блестит. (Золото.) Среди металлов самый славный, Важнейший древний элемент. В тяжелой индустрии главный, Знаком с ним школьник и студент. Родится в огненной стихии, Расплав его течет рекой. Важнее нет в металлургии, Он нужен всей стране родной. (Железо.) Хранят обычно в керосине, И бегает он по воде. В природе, помните отныне, Свободным нет его нигде. В солях его открыть возможно, Желтеет пламя от него, И получить из соли можно, Как Дэви получил его. (Натрий.) Давно известна человеку, Она тягуча и красна. Еще по бронзовому веку Знакома в сплавах всем она. С горячей серной кислотою Дает нам синий купорос, Белеет иногда, порою. Что за металл? Ответьте на вопрос. (Медь.) Иду на мелкую монету, В колоколах люблю звенеть, Мне ставят памятник за это И знают: имя мое -... Из глины я обыкновенной, Но я на редкость современный. Я не боюсь электротока, Бесстрашно в воздухе лечу; Служу на кухне я без срока - Мне все задачи по плечу. Горжусь своим я именем: Зовусь я... Пахать и стоить, все он может, если ему уголек в том поможет. (железо) По прозванью инвалид, но крепок в деле и на вид.(хром) Богатырем его не зря назвали, друг железа, помощник стали. (титан) Металл красой своей пленил и первым в топку угодил. (медь) Металл зимой не прочен: чума здоровье точит. (олово серое и белое) По прозвищу – богам он друг, в машинах прочен и упруг. (ванадий) "Живое серебро" и льется, и блестит, охотно с золотом дружит. (ртуть) Не трудна загадка эта: "Что металл роднит с планетой"? (уран) Металл в солях – опора многих, а нас без них, не носят ноги. (калий) Какой металл по древней мифологии обречен на "вечные муки"? (тантал) Какой элемент вращается вокруг солнца? (уран) Какой элемент всегда рад? (радон) Какие химические элементы состоят из различных рек? (Индий, Полоний, Радон, Нильсборий) Какой благородный металл состоит из болотных водорослей? (платина) Какой химический элемент пригоден для непрерывного нагревания или кипячения воды? (титан) ШАРАДЫ 1) Шарады: 1. Корабли меня обходят, Знает лоцман наизусть. Если «л» на «д» заменят, То металлом окажусь.(Мель, медь.) 2) Элемент четвертой группы Перед всеми на виду. Стоит «т» на «р» исправить, Будет деспот наяву.(Титан, тиран.) 3) Меня в таблице Менделеева Найдешь ты без труда, А если с «б» начнешь читать, То снежной бурей буду я.(Уран, буран.) 4) Заменив первую букву в названии химического элемента, получите название избыточно увлажненного участка земли, заросшего растениями.(Золото, болото.) 5) Возьмите первый слог названия «лунного элемента» и прибавьте к нему первый слог радиоактивного металла, открытого М.Склодовской-Кюри и П.Кюри в декабре 1898 г. Вы получите название элемента, производного от древнеиндийского слова, означающего светло-желтый цвет. (Сера: селен, радий.) 6) Итог урока. Выставление оценок. Формулируем общие характеристики элементов металлов I-III групп главных подгрупп. Семейство (тип элемента) – s или p. Число электронов на последнем энергетическом уровне (валентные электроны) – соответствует номеру группы. Степени окисления в соединениях – постоянные. Свойства простого вещества – металлические. Свойства соединений элементов с позиций теории окислительно-восстановительных реакций – восстановительные. Характер оксидов и гидроксидов – основной, у Al – амфотерный. Характеристика элементов-металлов побочных подгрупп. Семейство (тип элемента) – d. Число электронов на последнем энергетическом уровне – 1-2. Число валентных электронов – как правило, соответствует номеру группы (кроме VIII). Степени окисления в соединениях – переменные. Свойства соединений элементов – окислительные и восстановительные. Характер оксидов и гидроксидов – основной, амфотерный и кислотный. Формулируем общие характеристики элементов металлов I-III групп главных подгрупп. Семейство (тип элемента) – s или p. Число электронов на последнем энергетическом уровне (валентные электроны) – соответствует номеру группы. Степени окисления в соединениях – постоянные. Свойства простого вещества – металлические. Свойства соединений элементов с позиций теории окислительно-восстановительных реакций – восстановительные. Характер оксидов и гидроксидов – основной, у Al – амфотерный. Характеристика элементов-металлов побочных подгрупп. Семейство (тип элемента) – d. Число электронов на последнем энергетическом уровне – 1-2. Число валентных электронов – как правило, соответствует номеру группы (кроме VIII). Степени окисления в соединениях – переменные. Свойства соединений элементов – окислительные и восстановительные. Характер оксидов и гидроксидов – основной, амфотерный и кислотный. Формулируем общие характеристики элементов металлов I-III групп главных подгрупп. Семейство (тип элемента) – s или p. Число электронов на последнем энергетическом уровне (валентные электроны) – соответствует номеру группы. Степени окисления в соединениях – постоянные. Свойства простого вещества – металлические. Свойства соединений элементов с позиций теории окислительно-восстановительных реакций – восстановительные. Характер оксидов и гидроксидов – основной, у Al – амфотерный. Характеристика элементов-металлов побочных подгрупп. Семейство (тип элемента) – d. Число электронов на последнем энергетическом уровне – 1-2. Число валентных электронов – как правило, соответствует номеру группы (кроме VIII). Степени окисления в соединениях – переменные. Свойства соединений элементов – окислительные и восстановительные. Характер оксидов и гидроксидов – основной, амфотерный и кислотный. |