Уроках химии в 8 классе, как средства повышения интереса к химии. Методическая разработка Тагирова Наталья Александровна учитель химии
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
| Тема: Кислоты. Цель: Учащиеся должны знать: группы кислот по основным признакам классификации; типичные свойства кислот; условия протекания реакций, в которых вступают кислоты; Учащиеся должны уметь: составлять уравнения реакций, отражающих свойства кислот; давать характеристику кислот, используя различные классификации; использовать ряд напряжений металлов Задачи: Образовательная: Знать состав кислот, определения, составлять уравнения химических реакций; Развивающая: Развивать познавательный интерес и эмоции школьников, умение сравнивать, обобщать, делать выводы. Воспитательная: Продолжить формирование диалектико-материалистического мировоззрения. Формировать умение работать в коллективе, где развиваются доброжелательность и требовательность к себе и своему товарищу. Тип урока: Комбинированный. Оборудование и реактивы: Соляная кислота, цинк, медь, оксид меди, гидроксид натрия, растворы индикаторов (лакмус, метилоранжевый, фенолфталеин). Ход урока. I. Организационный момент. Учитель: Здравствуйте! Садитесь. Сегодня переходим к изучению нового класса неорганических веществ, который называется кислоты. Цель нашего сегодняшнего урока – изучить классификацию, состав и химические свойства кислот. II. Изучение новой темы. Учитель: В предыдущих параграфах мы с вами неоднократно сталкивались с тем или иным использованием кислот. Упоминались серная, соляная кислоты. С некоторыми кислотами мы встречаемся в повседневной жизни, может кто-то знает эти кислоты? Ученик: Лимонная, яблочная, уксусная, молочная. Учитель: Сейчас, послушав сообщения ваших одноклассников, узнаем, где содержатся кислоты и какую роль они выполняют. А в тетради сделаем небольшую схему. Напишите слово “Кислота” и от него несколько стрелок 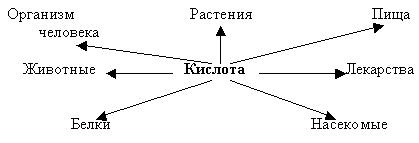 И по ходу сообщения запишите, где содержатся кислоты (сообщения 1 и 2). Теперь давайте проверим, что же у нас получилось (дети перечисляют, на доске отмечаем). Молодцы! А сейчас откройте учебник на странице 157, таблица “Классификация кислот”. В таблице приведены те неорганические кислоты, с которыми мы должны познакомиться. Что общего в формуле всех кислот? Ученик: Во всех кислотах содержатся атом водорода, и стоит он на первом месте. Учитель: Правильно. Давайте вспомним, с помощью каких веществ мы получали водород и напишем уравнение реакции на доске. Ученик: Учитель: А что происходило с атомом водорода в молекуле кислоты? Ученик: Цинк вытеснял атом водорода из молекулы. Учитель: На основании этого свойства давайте попробуем дать определение кислотам. Ученик: Кислоты – это сложные вещества, имеющие в своем составе водород, способный замещаться на металл. Учитель: Запишите определение в тетрадь. Действительно, если от молекулы кислоты убрать водород, то остается атом или группа атомов, которая называется кислотным остатком. А теперь вернемся к нашей таблице. Мы определили, что общее между всеми кислотами – это наличие водорода. А чем же они отличаются? Ученик: Количеством атомов водорода и содержанием кислорода. Учитель: Правильно! Есть кислоты, которые содержат кислород – их называют кислородосодержащие и без кислорода – бескислородные. Какие это? (формулы)  А по количеству атомов водорода кислоты делятся на следующие группы: 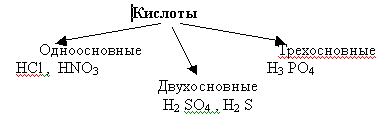 У меня на доске написаны формулы кислот с валентностями кислотных остатков Как вы думаете, каким образом я определила её? (числом атомов водорода). Правильно, по числу атомов водорода определяется валентность кислотного остатка. Какие это? Мы рассмотрели классификацию кислот. Как вы думаете, почему кислоты получили такое название? Ученик: Потому, что они кислые. Учитель: Правильно. Само название “кислота” показывает, что все кислоты имеют кислый вкус. Было время, когда единственным средством определения веществ были органы чувств. Постепенно химики научились распознавать кислоты, а как - об этом нам расскажет … (3 сообщение). А сейчас мы, как настоящие химики, с помощью индикатора распознаем кислоту и изучим их химические свойства. У нас на столах имеются лотки с необходимыми реактивами, не забывайте о правилах техники безопасности. 1. Действие индикатора. В пробирку с соляной кислотой добавьте несколько капель лакмуса. Что происходит? (демонстрация электронного пособия виртуальная лаборатория) 2. Взаимодействие с металлами. В одну пробирку с соляной кислотой добавьте цинк, (демонстрация электронного пособия виртуальная лаборатория) Что происходит? Напишите уравнение химической реакции 3. Взаимодействие с основными оксидами. В пробирку с соляной кислотой добавьте оксид меди. Перемешайте стеклянной палочкой, (демонстрация электронного пособия виртуальная лаборатория) Что происходит? Напишите уравнение химической реакции 4.Взаимодействие с гидроксидами металлов. В пробирку с гидроксидом натрия (малиновый) добавьте соляной кислоты. Что происходит? (демонстрация электронного пособия виртуальная лаборатория) Молодцы! Подведем итог. III. Закрепление. Вы должны были написать уравнения химических реакций. Теперь проверьте правильность написания их и оцените себя (доска) по следующим параметрам: мне было легко (нет ошибок); я затруднялся (1 ошибка); мне было трудно (2 и более). IV. Итог урока. Отсюда вам следующее домашнее задание: кому было легко - &38, упражнение 4,3; затруднялся - & 38, упражнение 1,2; трудно – конспект урока. 44 |