№
|
Тема урока
|
Количество часов
|
Тип урока
|
Элементы содержание
|
Требования к уровню подготовки обучающихся
|
Вид контроля.
Измерители
|
Эксперимент
(Д. – демонстрационный
Л. – лабораторный) /
Домашнее задание.
|
Дата проведения
|
план
|
факт
|
Введение (6 часов)
|
1
|
Предмет химии. Вещества.
|
1 час
|
К.у
|
Что изучает химия? Вещества, как объект изучения химии. Физические свойства веществ.
CD:Вирт. Лаб. Кол-ция/Перв.хим. понятия/предмет химии.Вещества и их свойства.
CD:Кирилл и Мефодий/ Химия-неорг.химия-осн.понятия
|
Д.З. – предмет химии;
- физические свойства, вещества.
Д.У. – описывать физические свойства;
- различать вещества и тела
|
1. Что является предметом химии
2. упр.3 стр. 6
3. упр. 4-5 стр.7
|
Д. Коллекция физических
тел из стекла, пластмасс,
алюминия
§1 упр 1,2
|
|
|
2
|
Простые и сложные вещества
|
1 час
|
К.у
|
CD:Вирт. Лаб Перв.хим. понятия/предмет химии.Вещества и их свойства/
Хим. Элемент
Название хим. Элементов
Хим. формулы
|
Д.З. – определения сложных и простых веществ.
|
Какие вещества называются сложными, а какие простыми?
|
Выучить определение
простых и сложных
веществ.
|
|
|
3.
|
Превращение веществ
|
1 час
|
К.у
|
Химические реакции как объект изучения химии. Отличия физических явлений от химических. Значение физических и химических явлений
CD:Вирт. Лаб Кол-ция/Перв.хим. понятия/предмет химии. Вещества и их свойства.
Алхимия
|
Д.З. – сущность физических и химических явлений;
- отличия химических явлений от физических явлений
Д.У. – объяснить отличия физических явлений от химических явлений;
- приводить примеры физических и химических явлений
|
Учебник: стр. 9, упр 1-3. Чем отличаются химические реакции от физических явлений.
|
Л. «Нагревание Н2О»;
«Взаимодействие
с СаСО3»;
«Вулкан»
«Помутнение известковой
воды»
§2 стр.9, упр. 1-3,4
|
|
|
4.
|
Знаки химичес-
ких элемен-
тов. Периодическая система
|
1 час
|
К.у
|
Химический элемент. Знаки химических элементов. Происхождение названий химических элементов. Структура. Период. Системы малые и большие периоды, группы: главная и побочная подгруппы.
CD:Вирт. Лаб Кол-ция/ПЗ Д. И. Менделеева/ПЗ Д. И. М основа современной химии. Таблица/ПСХЭ.
CD:Открытая химия.2.5 период. Сис-ма
|
Д.З. – название и обозначение химических элементов;
- структуру периодической системы Менделеева.
Д.У. – называть химические элементы по символу;
- записывать химические символы по названию;
- составлять «домашние адреса» химических элементов.
|
Учебник стр.18 упр. 1,3,5
Рассказать о структуре Периодической Системы.
|
§ 4, выучить
Периодическую
таблицу упр. 1-4.
Составить
«домашний адрес»
для АL,
C, Na.
|
|
|
5.
|
Химические формулы.
|
1 час
|
К.у
|
Молекула. Химическая формула. Индексы и коэффициенты. Качественный и кол- ый состав веществ.
CD:Вирт. Лаб.Перв.хим. понятия/предмет химии.Вещества и их свойства.
Хим. Ф-лы
Д. эксперемент:примеры физ. И хим. явлений.
|
Д.З. – алгоритм записи химической формулы;
- что обозначает индекс и коэффициент в химических формулах.
Д.У. - читать химические формулы
- записывать химические формулы
- определять по химическим формулам качественный и кол-ый состав веществ.
- определять по формулам простые и сложные вещества.
|
Что обозначает запись 5Н2О
Назвать коэффициент и индекс, что они обозначают? Определите качественный и кол-ый состав вещества. стр. 20 упр.3-5
Прочитайте формулы: HCL, NO2, H2S, 7H2SO4, 2CL2, 7O2; определите простые и сложные вещества
|
§ 5 до стр. 19, стр. 20
упр. 3,4,5.
|
|
|
Атомы химических элементов (9 часов)
|
6.
|
Относи-
тельная атомная и молеку-
лярная массы
|
1 час
|
К.у
|
CD:Вирт. Лаб Кол-ция/Перв.хим. понятия/Атомы хим. Элементов/
Атомная гипотеза
Открытие Рентгеновских лучей
Открытие радиоактивности
CD:Открытая химия. 1.1Понятие об атомах
|
Д.З. – что означает О.А.М. и О.М.М.
Д.У. – определять и рассчитать Ar и Mr
|
cтр. 20 упр. 1-2
Вычислить Mr:
H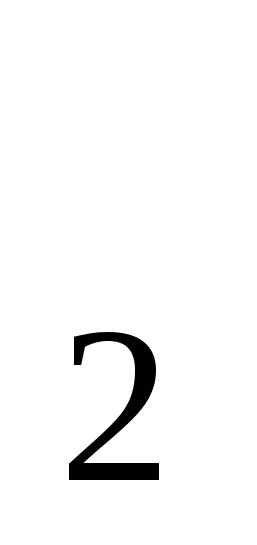 SO4; MgCO3; CL2; Ca3 (PO4)2 SO4; MgCO3; CL2; Ca3 (PO4)2
|
§ 5 до конца. Вычислить
Mr: C12H22O11; HCLO4;
NH3; CaHCO3
|
|
|
7.
|
Строение атома.
|
1 час
|
К.у
|
Доказательство сложности строения атомов – опыты Резерфорда. Планетарная модель строения атома. Состав атома: протоны, нейтроны, электроны.
CD:Вирт. Лаб Открытие электрона
Модели стр. атома
Опыт Резерфорда
Планетарная модель стр. атома
Общее стр. атома. CD:Кирилл и Мефодий/Химия-неорг.химия-строение в-в:-строение атома, молекул
|
Д.З. – о сложном строение атома;
- состав атома: протоны, нейтроны, электроны.
- Основные характеристики элементарных частиц.
Д.У. – определять состав атома, используя Периодическую Систему.
|
стр. 24. упр. 1,3. Перечислить основные характеристики элементарных частиц.
|
Выучить стр.25
таблица №2, §6 упр.3
строение атомов N, Mg,
AL, CL.
|
|
|
8.
|
Изотопы. Измене-
ния в составе ядер атомов.
|
1 час
|
К.у
|
Современное определение понятие «химический элемент». Изотопы как разновидности атомов одного и того же элемента.
CD:Вирт. Лаб Кол-ция/Перв.хим. понятия/Атомы хим. Эементов/
Электронные оболочки атомов
Стр. атомов: N2, K, FE
|
Д.З. – современное определение «химический элемент»
|
Что называется «изотопами»? Дать современную формулировку понятию «химический элемент»
|
§7, выучить опорные
понятия.
|
|
|
9.
|
Электро-
ны. Строение электронных оболочек атомов.
|
1 час
|
К.у
|
Электронная оболочка атомов, энергетический уровень, строения электронных оболочек атомов элементов малых периодов.
CD:Вирт. Лаб Кол-ция/Перв.хим. понятия/предмет химии.Вещества и их свойства/
Хим. Элемент
|
Д.З. - определение понятия «электронное облако»
Д.У. – определять число энергетических уровней по номеру периода
- определять максимальное число электронов на одном уровне N = 2n2
- определять число ē – на внешнем энергетическом уровне.
|
стр. 33 упр 1,2,3
|
§8, выучить, составить
схемы строения атомов
Ca, AL, C.
|
|
|
10.
|
Периоди-
ческая Система химичес-
ких элемен-
тов. Строение атомов и свойства элементов
|
1 час
|
К.у
|
Изменения свойств элементов в периодах и группах.
CD:Вирт. Лаб Кол-ция/Перв.хим. понятия/Атомы хим. Эементов/
Э.О
|
Д.З.- физический смысл порядкового номера, номера группы, периода.
- характеристику неметаллических и металлических свойств элементов
- закономерности изменения свойств элементов в группе и периоде.
Д.У. – уметь называть закономерности изменения свойств.
|
стр. 38 упр.3. В чем физический смысл порядкового номера, группы, периода? Охарактеризуйте НеМе и Ме свойства элементов и их изменения в группе и периоде.
|
§9, прочитать до
стр. 36, выучить
стр. 38 упр.1.
|
|
|
11.
|
Ионная химическая связь.
|
1 час
|
К.у
|
Ионы. Понятия об ионной связи. Схема образования ионной связи
CD:Вирт. Лаб Кол-ция/Перв.хим. понятия/Атомы хим. Эементов/
Ионная связь
CD:Открытая химия.3.1 Хим.связь, 3.2 типы хим. Связи.
|
Д.З. – понятие «ионы»; «ионная связь»;
Д.У. – изображать схемы «ионной связи».
|
Дать определение «ионы», «ионная связь».
стр. 38 упр.2.
|
§9 до конца стр.34-35
упр. 2
|
|
|
12.
|
Образо-
вание молекул простых веществ.
|
1 час
|
К.у
|
Ковалентная химическая связь. Структурные формулы. Кратность химической связи. Электронные формулы. Металлическая связь.
CD:Вирт. Лаб Ковалентная полярная и неполярная
Типы ков. св.
Ме. Св
Д. эксп. Движение окрашенных ионов в
Эл. Поле.(ч.з кодоскоп)
|
Д.З. – понятия: ковалентной химической связи, структурные формулы, электронные формулы, кратность химической связи, Ме связь.
Д.У. – составлять схемы образования двух атомных молекул: CL2, S2, N2. O2.
- записывать структурные, электронные формулы простых веществ
- определять кратность связи;
- написать черты сходства и отличия ков–ой и Ме связью.
|
стр. 41 упр. 1,2,3,4. Дать определение понятий: «Ковалентная химическая связь» «Ме связь», «Кратность связи». Что отображают структурная, электронная формулы.
|
§10 упр.1-4 заполнить
таблицу «сравнительная
характеристика ионной
и ковалентной
связью с Ме
|
|
|
13.
|
Ковале-
нтно – полярная связь.
|
1 час
|
К.у
|
Виды химической связи – ковалентная неполярная и ковалентная полярная. Электроотрицательность.
|
Д.З. – понятия: «электроотрицательность», «ковалентная полярная и ковалентная неполярная связи», «частичный заряд», ряд электротрицательности элементов.
Д.У. – составлять схемы образования молекул HCL, NH3, H2O и др.
- определять тип химической связи в соединениях
- определять более или менее полярные связи.
|
стр. 44 упр. 2,3,4
Расшифруйте понятия:
- электроотрица-
тельность
- ряд электроотрица-
тельности химических элементов
- ковалентная полярная связь
|
§11 стр.44 упр. 2,3.
|
|
|
14.
|
Обобще-
ние и повторе-
ние мате-
риала. Подго-
товка к конт-
рольной работе.
|
1 час
|
Об
|
|
|
|
|
|
|
15.
|
Контро-
льная работа №1
|
1 час
|
К.р
|
|
|
|
|
|
|
Простые вещества (3 часа)
|
16.
|
Анализ контрольной работы.
Простые вещества: металлы и неметал-
лы.
|
1 час
|
К.у
|
Положение - НеМе и Ме в периодической системе. Физические свойства НеМе и Ме важнейшие простые вещества Ме: Fe, AL, Ca, Na, Mg, K ; HeMe: O2, N2, H2, S, P, C.
Аллотропия
CD:Вирт. Лаб Кол-ция/Перв.хим. понятия/В-ва
Ме
неМе
Пластичность
Ме ьлеск
Электро- и тепломроводность Ме
Аллотропия О2, С, Sn
|
Д.З. – положения НеМе и Ме в периодической системе;
- общие физические свойства НеМе и Ме;
- понятия аллотропии.
Д.У. – объяснять свойства простых вещества на основании их строения
- приводить примеры простых веществ НеМе и Ме
|
Охарактеризуйте положения НеМе и Ме в периодической системе;
Назовите общие свойства НеМе и Ме Чем они обусловлены?
Что называется аллотропией?.Приведите примеры аллотропных видоизменений химических элементов-кислорода. фосфора
Приведите примеры важнейших простых веществ НеМе и Ме
|
§13 - §14 до стр. 53
|
|
|
17.
|
Коли-
чество вещества. Молярная масса. Моляр-
ный объем газов.
|
1 час
|
К.у
|
Количество вещества и его единицы «моль»; Постоянная Авогадро. Расчет молярной массы по химической формуле, молярный объем газов.
CD:Вирт. Лаб Перв.хим. понятия/В-ва
n
n и число Авогадро Na
n и Vm
n и M
Д.физ.св-ва Ме. Изготовление моделей 1 моль различных в-в
|
Д.З. – понятия : «моль», «количество вещества», «молярная масса», «постоянная Авогадро» обозначения и единицы измерения.
n, M, N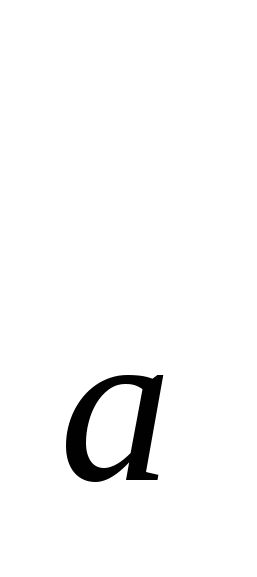 ,V, Vm ,V, Vm
Д.У. – производить вычисления молярной массы по химической формуле
- решать задачи.
|
Понятия: «моль», «количество вещества», «молярная масса», «постоянная Авогадро»
Как обозначаются и в чем измеряются данные величины?
стр. 56 упр.2,3
|
§ 15, выучить формулы
стр. 56 упр.2,3.
§16 прочитать
|
|
|
18.
|
Решение задач.
|
1 час
|
К.у
|
Решение задач и упражнений с использованием характеристик:
количество вещества
молярная масса;
молярный объем
постоянная Авогадро.
CD: Решение задач самоучитель
|
Д.У. – производить вычисления по формулам.
см. №/№ 17
|
|
|
|
|
Соединения химических элементов (10 часов)
|
19.
|
Валент-
ность.
|
1 час
|
К.у
|
Понятия о химической номенклатуре бинарных соединений.
|
Д.З. – понятия валентности;
Д.У. – определять валентность в бинарных соединений;
- составлять формулы по валентности;
- называть бинарные соединения.
|
Стр. 63 упр. 1,2
|
§ 17 стр.63 упр. 1,2
|
|
|
20.
|
Оксиды.
|
1 час
|
К.у
|
Составление формул оксидов, их названия; представители оксидов.
CD:Вирт. Лаб Перв.хим. понятия/В-ва
Оксиды, Основания, кислоты, соли.
|
Д.З. – понятия оксиды
Д.У. – определять принадлежность вещества к классу оксидов давать названия оксидам
|
стр. 66 упр.1
|
§18 прочитать
упр.1,2 образцы оксидов.
|
|
|
21.
|
Основа-
ния.
|
1 час
|
К.у
|
Состав, названия и классификация оснований, основные представители оснований (NaOH, KOH, Ca (OH)2). Индикаторы и качественные реакции.
CD:Кирилл и Мефодий/Химия-нерг.химия-химия элементов и их соединений-основные классы неорг.в-в
|
Д.З. – понятия; основания, гидроксогруппа, гидроксид-ион, щелочность, индикаторы качественные реакции.
- названия классификацию оснований
- основных представители щелочей
- основные индикаторы и изменения окрашивания в щелочной среде.
- основные свойства NaОН, KOH, Ca (OH)2 и их использование.
Д.У. – определять принадлежность веществ к классу оснований
- называть основания по их формуле
- составлять формулы оснований.
|
|
Образцы щелочей и
нерастворимых
оснований. Изменение
окраски индикаторов
в щелочной среде.
Стр 64. таблица 4.
§19, выучить, выписать
свойства и применение:
КОН, NaOH, Ca (OH)2?
Стр 69 упр 2-4
|
|
|
 Скачать 0.59 Mb.
Скачать 0.59 Mb.