Протокол № от 2012 г. Согласовано Заместитель директора школы по увр
 Скачать 0.76 Mb. Скачать 0.76 Mb.
|
| Тема 1. Электролитическая диссоциация (10 ч) Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах. Ионы. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей. Сильные и слабые электролиты. Степень диссоциации. Реакции ионного обмена. Окислительно-восстановительные реакции. Окислитель. Восстановитель. Гидролиз солей. Демонстрации. Испытание веществ на электронную проводимость Движение ионов в электрическом поле. Лабораторные опыты. Реакции обмена между растворами электролитов. Практическая работа. Решение экспериментальных задач по теме «Электролитическая диссоциация». Тема 2. Кислород и сера (9 ч) Положение кислорода и серы в ПСХЭ, строение их атомов. Аллотропия кислорода – озон. Сера. Аллотропия серы. Физические и химические свойства. Нахождение в природе. Применение серы. Оксид серы (4). Сероводородная и сернистая кислоты и их соли. Оксид серы (VI). Серная кислота и ее соли. Окислительные свойства серной кислоты. Понятие о скорости химической реакции. Катализаторы. Демонстрации: Аллотропия кислорода и серы. Знакомство с образцами природных соединений серы. Лабораторные опыты. Распознавание сульфат – ионов, сульфит-ионов и сульфид – ионов в растворе. Практическая работа. Решение экспериментальных задач по теме «Кислород и сера» Расчетные задачи. Вычисления по химическим уравнениям массы (количества, объема) вещества по известной массе (количеству, объему) одного из вступивших или получающихся в результате реакции веществ. Тема 3. Азот и фосфор (10 ч) Положение азота и фосфора в ПСХЭ, строение их атомов. Азот, физические и химические свойства, получение и применение. Круговорот азота в природе. Аммиак: физические и химические свойства, получение и применение. Соли аммония . Оксиды азота (2) и (4). Азотная кислота и ее соли. Окислительные свойства азотной кислоты. Фосфор. Аллотропия фосфора. Физические и химические свойства фосфора. Оксид фосфора (V). Ортофосфорная кислота и ее соли. Минеральные удобрения. Демонстрации. Получение аммиака и его растворение в воде. Ознакомление с образцами природных нитратов, фосфатов. Лабораторные опыты. Взаимодействие солей аммония со щелочами. Ознакомление с азотными и фосфорными удобрениями. Практические работы. Получение аммиака и изучение его свойств. Определение минеральных удобрений. Тема 4. Углерод и кремний (7 ч) Положение углерода и кремния в ПСХЭ, строение их атомов. Углерод, аллотропные модификации, физические и химические свойства углерода. Круговорот углерода в природе. Угарный газ, свойства и физиологическое действие на организм. Углекислый газ. Угольная кислота и ее соли. Кремний. Оксид кремния (4). Кремниевая кислота и ее соли. Стекло. Цемент. Демонстрации. Кристаллическая решетка угля и графита. Знакомство с образцами природных карбонатов и силикатов. Ознакомление с видами стекла. Лабораторные опыты. Ознакомление со свойствами и взаимопревращениями карбонатов и гидрокарбонатов. Качественная реакция на карбонат – и силикат – ион. Практическая работа. Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов. Тема 5. Общие свойства металлов (14 ч) Положение металлов в ПСХЭ Д.И.Менделеева. Металлическая связь. Физические и химические свойства металлов. Ряд напряжения металлов. Понятие о металлургии. Способы получения металлов. Сплавы (сталь, чугун, дюралюминий, бронза). Проблемы безотходного производства в металлургии и охрана окружающей среды. Щелочные металлы. Положение щелочных металлов в периодической системе и строение атомов. Нахождение в природе. Физические и химические свойства. Применение щелочных металлов и их соединений. Кальций и его соединения. Жесткость воды и способы ее устранения. Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства алюминия. Амфотерность оксида и гидроксида алюминия. Железо. Положение железа в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства железа. Оксиды, гидроксиды и соли железа (II) и железа (III) Демонстрации. Знакомство с образцами важнейших соединений натрия, калия, природных соединений кальция, рудами железа, соединениями алюминия. Взаимодействие щелочных, щелочноземельных металлов и алюминия с водой. Сжигание железа в кислороде и хлоре. Лабораторные опыты. Получение гидроксида алюминия и взаимодействие его с кислотами и щелочами. Получение гидроксидов железа (2) и (3) и взаимодействие их с кислотами и щелочами. Практические работы. Решение экспериментальных задач по теме «Элементы 1а – 3а групп периодической системы химических элементов». Решение экспериментальных задач по теме «Металлы и их соединения». Расчетные задачи. Вычисление по химическим уравнениям массы, объема или количества вещества одного из продуктов реакции по массе исходного вещества, объему или количеству вещества, содержащего определенную долю примесей. Тема 6. Первоначальные представления об органических веществах (2ч) Первоначальные сведения о строении органических веществ. Основные положения теории органических соединений А.М. Бутлерова. Изомерия. Упрощенная классификация органических соединений. Тема 7. Углеводороды (4 ч) Предельные углеводороды. Метан, этан. Физические и химические свойства. Применение. Непредельные углеводороды. Этилен: физические и химические свойства. Ацетилен. Диеновые углеводороды. Понятия о циклических углеводородах. Природные источники углеводородов, их значимость. Защита атмосферного воздуха от загрязнений. Демонстрации. Модели молекул органических соединений. Горение метана и обнаружение продуктов горения. Горение этилена и обнаружение продуктов горения. Качественная реакция на этилен. Образцы нефти и продуктов их переработки. Лабораторные опыты. Этилен, его получение, свойства. Расчетная задача. Установление простейшей формулы вещества по массовым долям элементов. Тема 8. Спирты (3 ч) Одноатомные спирты. Метанол. Этанол. Физические свойства. Физиологическое действие спиртов на организм. Применение. Многоатомные спирты. Этиленгликоль. Глицерин. Применение. Демонстрации. Количественный опыт выделения водорода из этилового спирта. Растворение этилового спирта в воде. Растворение глицерина в воде. Качественная реакция на многоатомные спирты. Тема 9. Карбоновые кислоты. Жиры (3ч) Муравьиная и уксусная кислоты. Физические свойства. Применение. Высшие карбоновые кислоты. Стеариновая кислота. Жиры – продукты взаимодействия глицерина и высших карбоновых кислот. Роль жиров в процессе обмена веществ в организме. Калорийность жиров. Демонстрации. Получение и свойства уксусной кислоты. . Исследование свойств жиров: растворимость в воде и органических растворителях. Тема 10. Углеводы (2 ч) Глюкоза, сахароза – важнейшие представители углеводов. Нахождение в природе. Фотосинтез. Роль глюкозы в питании и укреплении здоровья. Крахмал и целлюлоза – природные полимеры. Нахождение в природе. Применение. Демонстрации. Качественные реакции на глюкозу и крахмал. Тема 11. Белки. Полимеры (5 ч) Белки – биополимеры. Состав белков. Функции белков. Роль белков в питании. Понятие о ферментах и гормонах. Полимеры – высокомолекулярные соединения. Полиэтилен. Полипропилен. Поливинилхлорид. Применение полимеров. Химия и здоровье. Лекарства. Демонстрации. Качественные реакции на белок. Ознакомление с образцами изделий из полиэтилена, полипропилена, поливинилхлорида. ФОРМЫ И СРЕДСТВА КОНТРОЛЯ КОНТРОЛЬ ЗНАНИЙ, УМЕНИЙ, НАВЫКОВ ( текущий, рубежный) осуществляется следующими образом ФОРМЫ КОНТРОЛЯ
Все тексты для контроля знаний, умений и навыков учащихся предлагаются из методического пособия Брейгер Л.М. Химия. 9 класс: контрольные и самостоятельные работы, тесты / Л.М.Брейгер. – Волгоград: Учитель, 2006) КРИТЕРИИ И НОРМЫ ОЦЕНКИ ЗНАНИЙ ОБУЧАЮЩИХСЯ 1. Оценка устного ответа. Отметка «5» : - ответ полный и правильный на основании изученных теорий; - материал изложен в определенной логической последовательности, литературным языком; - ответ самостоятельный. Ответ «4» ; - ответ полный и правильный на сновании изученных теорий; - материал изложен в определенной логической последовательности, при этом допущены две-три несущественные ошибки, исправленные по требованию учителя. Отметка «З» : - ответ полный, но при этом допущена существенная ошибка или ответ неполный, несвязный. Отметка «2» : - при ответе обнаружено непонимание учащимся основного содержания учебного материала или допущены существенные ошибки, которые учащийся не может исправить при наводящих вопросах учителя, отсутствие ответа. 2. Оценка экспериментальных умений. - Оценка ставится на основании наблюдения за учащимися и письменного отчета за работу. Отметка «5»: - работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы; - эксперимент осуществлен по плану с учетом техники безопасности и правил работы с веществами и оборудованием; - проявлены организационно - трудовые умения, поддерживаются чистота рабочего места и порядок (на столе, экономно используются реактивы). Отметка «4» : - работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием. Отметка «3»: - работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента в объяснении, в оформлении работы, в соблюдении правил техники безопасности на работе с веществами и оборудованием, которая исправляется по требованию учителя. Отметка «2»: - допущены две (и более) существенные ошибки в ходе: эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя; - работа не выполнена, у учащегося отсутствует экспериментальные умения. 3. Оценка умений решать расчетные задачи. Отметка «5»: - в логическом рассуждении и решении нет ошибок, задача решена рациональным способом; Отметка «4»: - в логическом рассуждении и решения нет существенных ошибок, но задача решена нерациональным способом, или допущено не более двух несущественных ошибок. Отметка «3»: - в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах. Отметка «2»: - имеется существенные ошибки в логическом рассуждении и в решении. - отсутствие ответа на задание. 4. Оценка письменных контрольных работ. Отметка «5»: - ответ полный и правильный, возможна несущественная ошибка. Отметка «4»: - ответ неполный или допущено не более двух несущественных ошибок. Отметка «3»: - работа выполнена не менее чем наполовину, допущена одна существенная ошибка и при этом две-три несущественные. Отметка «2»: - работа выполнена меньше чем наполовину или содержит несколько существенных ошибок. - работа не выполнена. При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима. 5. Оценка тестовых работ. Тесты, состоящие из пяти вопросов можно использовать после изучения каждого материала (урока). Тест из 10—15 вопросов используется для периодического контроля. Тест из 20—30 вопросов необходимо использовать для итогового контроля. При оценивании используется следующая шкала: для теста из пяти вопросов • нет ошибок — оценка «5»; • одна ошибка - оценка «4»; • две ошибки — оценка «З»; • три ошибки — оценка «2». Для теста из 30 вопросов: • 25—З0 правильных ответов — оценка «5»; • 19—24 правильных ответов — оценка «4»; • 13—18 правильных ответов — оценка «З»; • меньше 12 правильных ответов — оценка «2». 6. Оценка реферата. Реферат оценивается по следующим критериям: • соблюдение требований к его оформлению; • необходимость и достаточность для раскрытия темы приведенной в тексте реферата информации; • умение обучающегося свободно излагать основные идеи, отраженные в реферате; • способность обучающегося понять суть задаваемых членами аттестационной комиссии вопросов и сформулировать точные ответы на них. Стартовая контрольная работа Вариант 1. 1.Дополнить: Химический элемент магний находится в____________периоде, _________группе, ___________подгруппе. 2.Выбрать правильный ответ: Атом кислорода имеет следующее распределение электронов по энергетическим уровням:
3.Дополнить: В периоде с возрастанием порядкового номера у химических элементов металлические свойства___________, а неметаллические свойства____________. 4.Выбрать правильный ответ: В веществах, имеющих химические формулы O2, HCI, M9O
5.Установить соответствие:(назвать вещества)
Вариант 2. 1.Дополнить: Номер периода указывает на____________. 2. Выбрать правильный ответ: Атом хлора имеет следующее распределение электронов по энергетическим уровням:
3. Дополнить: В главной подгруппе с возрастанием порядкового номера у химических элементов металлические свойства___________, а неметаллические свойства____________. 4. Выбрать правильный ответ: В веществах, имеющих химические формулы H2, CuO, H2O
5. Установить соответствие:(назвать вещества)
Итоговая контрольная работа по курсу неорганической химии 9 класса В 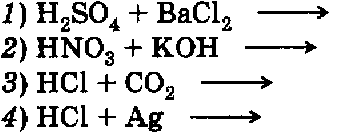 ариант 1 ариант 1Задание 1. Напишите ионные уравнения осуществимых химических реакций: Задание 2. а) С какими из перечисленных веществ: карбонат натрия (р-р), хлорид кальция (р-р), углекислый газ, оксид железа (II) — может взаимодействовать известковая вода? Напишите ионные уравнения реакций. б) Между какими из перечисленных веществ: соляная кислота, карбонат кальция, растворы гидроксида лития и хлорида железа (III), цинк — возможны химические реакции? Напишите ионные уравнения реакций. Задание 3. Напишите уравнения реакций, с помощью которых можно осуществить превращения веществ: 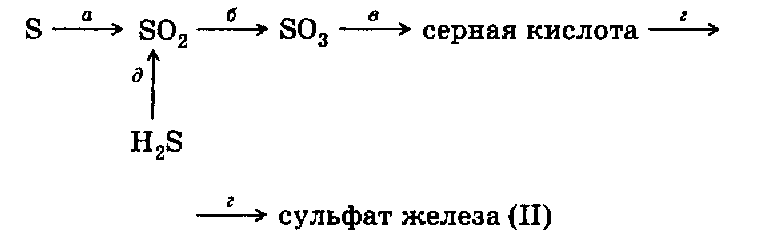 Задание 4. Решите одну из задач. а)Через раствор, содержащий 5,6 г гидроксида калия, пропустили избыток хлористого водорода. Какое количество соли образовалось? б) Каков объем сернистого газа (н. у.), полученного при сжигании 1 кг серы, содержащей 4% примесей? в) Какой объем сернистого газа может быть получен при обжиге 1,2 т пирита FеS2 с выходом 75% ? Вариант 2 Задание 1. Напишите ионные уравнения осуществимых химических реакций; 1) НС1 + АlCl3 2) Н2SО4 + Са(ОН)2 3) HС1 + Си 4) Си(ОН)2 + НNO3 Задание 2. а) С какими из перечисленных веществ: гидроксидом натрия (р-р), хлоридом натрия (р-р), оксидом серы (VI), оксидом железа (И) — может взаимодействовать в растворе сульфат меди (II)? Напишите ионные уравнения реакций б) Между какими из перечисленных веществ: раствор серной кислоты, гидроксид железа (II), железо, углекислый газ, раствор гидроксида бария — возможны химические реакции? Напишите ионные уравнения реакций. Задание 3. Напишите уравнения химических реакций, с помощью которых можно осуществить превращения: 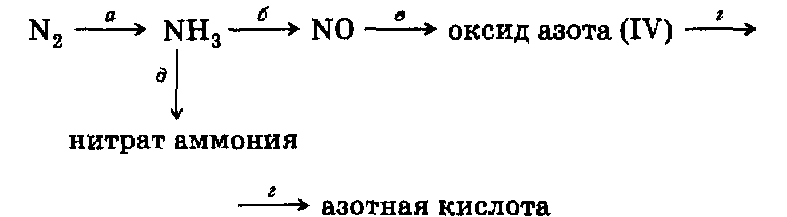 Задание 4. Решите одну из задач. а) Рассчитайте объем водорода (н. у.), образовавшегося при действии избытка соляной кислоты на 195 г цинка. б) Какова масса соли, образовавшейся при пропускании 5 моль углекислого газа через известковую воду, содержащую 2 моль гидроксида кальция? ПЕРЕЧЕНЬ УЧЕБНО - МЕТОДИЧЕСКИХ СРЕДСТВ ОБУЧЕНИЯ 1. Основная литература
2. Дополнительная литература
MULTIMEDIA – поддержка предмета:
3.Оборудование и приборы
Перечень средств обучения для 9 класса, находящихся в кабинете химии. 1. Методическая литература.
2. Методическая литература по внеклассной работе.
3. Пособия для проведения контрольных и самостоятельных работ.
4.Литература для подготовки к олимпиадам по химии.
|